Documento OCSE su Health Technology Assessment
Un recente documento dell’Organizzazione per la Cooperazione e lo Sviluppo Economico (OCSE) ha riassunto le principali normative e i vari approcci nazionali in modo da normare l’Health Technology Assessment. L’iniziativa OCSE concentra la sua attenzione sulle tecnologie digitali, inclusi dispositivi medici e farmaci.
A tal riguardo, gli approcci dei vari paesi sono diversi e influenzati dal contesto e dal panorama legislativo.
Normare l’Health Technology Assessment in Francia
In Francia per poter beneficiare del rimborso da parte del sistema assicurativo nazionale, i dispositivi medici destinati all’uso individuale nella comunità devono essere inseriti nell’elenco dei prodotti e servizi rimborsabili (LPPR Liste des produits et Prestations Remboursables).
Al fine di normare l’Health Technology Assessment, dal 2023 è stato creato un nuovo sistema destinato, in particolare, alla valutazione dei suddetti dispositivi. Il che ha comportato la creazione di un nuovo percorso di rimborso per i dispositivi di monitoraggio medico (a distanza) in particolare, nel contesto delle malattie croniche.
Tale processo normativo è noto come LATM (Liste des Activites de Télésurveillance Médicale) e può essere considerato, insieme all’LPPR, il percorso comune per il rimborso dei dispositivi medici digitali nell’ambito del sistema assicurativo nazionale.
Il nuovo modello ha inoltre introdotto il concetto di copertura anticipata, a monte dell’LPPR e del LATM, per i dispositivi medici digitali “presumibilmente innovativi” riguardanti il monitoraggio medico a distanza.
Questo percorso accelerato, noto come PECAN (Prise en Charge Anticipes des Dispositifs Medicaux Numériques), prevede il rimborso temporaneo di una tecnologia promettente per un massimo di un anno, non rinnovabile, in attesa di ulteriori prove.
Le tariffe del rimborso per i dispositivi medici digitali terapeutici sono stabilite dalla legge francese. L’azienda deve presentare una domanda completa tramite il normale LPPR o LATM.
Germania
In Germania la Commissione Federale Paritetica (G-BA, Gemeinsemer Bundesausschuss) è responsabile della valutazione dei benefici aggiuntivi dei dispositivi medici coperti dal sistema assicurativo sanitario pubblico tedesco.
La G-BA può incaricare l’istituto per la qualità e l’efficienza dell’assistenza sanitaria di effettuare una valutazione dettagliata sulla base delle prove presentate dall’azienda, su cui basare la propria decisione.
Il digital Health-Care Act tedesco del 2019 ha portato alla creazione di un nuovo percorso combinato di approvazione normativa e rimborso per i dispositivi a basso rischio. Le applicazioni di assistenza sanitaria digitale incentrate sul paziente saranno coperte dal sistema assicurativo sanitario tedesco.
L’agenzia di regolamentazione tedesca per i prodotti farmaceutici e i dispositivi medici è responsabile della valutazione di queste tecnologie in base ai requisiti generali (protezione e sicurezza dei dati, funzionalità, interoperabilità) e agli effetti positivi sull’assistenza.
Dopo una valutazione iniziale entro tre mesi dalla richiesta, i farmaci possono essere inseriti direttamente nell’elenco così da essere prescritti e rimborsati se presentano prove sufficienti di beneficio clinico, mentre altri possono essere inseriti provvisoriamente o respinti.
Israele
In Israele, le tecnologie sanitarie sono incluse nell’elenco nazionale dei servizi sanitari (NLHS), come diritti, piuttosto che come prodotti a sé stanti. I diritti si riferiscono al tipo di servizio offerto da una tecnologia, il suo percorso clinico o il servizio medico fornito.
Il comitato per l’aggiornamento dell’elenco nazionale dei servizi sanitari (NLHS) che fa capo al Ministero della Salute, formula delle raccomandazioni annuali su quali dispositivi e tecnologie mediche approvati dalla normativa dovrebbero essere inclusi nella copertura sanitaria nazionale. Il tutto sulla base delle valutazioni delle tecnologie sanitarie e tenendo conto del budget stanziato dal governo per la giunta della tecnologia all’NLHS per il successivo anno di bilancio.
Il processo di aggiornamento è tradizionalmente adatto per tecnologie sanitarie consolidate, come prodotti farmaceutici e dispositivi medici con evidenze cliniche a supporto delle loro affermazioni, ed è meno adattabile alle tecnologie sanitarie digitali che attualmente potrebbero non soddisfarne i requisiti.
Spagna
In Spagna la popolazione beneficia di diversi servizi medici, come descritto in tre pacchetti di prestazioni:
- il pacchetto di prestazioni comuni, definito a livello nazionale;
- i pacchetti di prestazioni complementari, determinati a livello regionale dalle comunità autonome spagnole;
- i pacchetti di prestazioni ospedaliere a livello ospedaliero.
Le valutazioni HTA vengono utilizzate per orientare il processo decisionale sull’inclusione dei servizi medici in tutti questi pacchetti, ma sono condotte da istituzioni diverse. La rete spagnola di agenzie per la valutazione delle tecnologie e delle prestazioni del sistema sanitario nazionale (RedETS) è responsabile della HTA fornendo anche consulenza sull’inclusione nel pacchetto di prestazioni comuni per tutti i residenti spagnoli. Le valutazioni sono condivise tra reti di 8 agenzie HTA regionali in modo da sviluppare report che seguono la stessa metodologia, in collaborazione tra loro. Una volta che un HTA è stato seguito da RedETS, le raccomandazioni e le deliberazioni vengono discusse con i diversi stakeholder fino a quando una commissione interministeriale non raggiunge la decisione finale. Una volta che un nuovo servizio è incluso nel pacchetto di benefici comuni, è responsabilità di ogni comunità autonoma garantirne la disponibilità dell’erogazione a livello locale.
Regno Unito
In Inghilterra l’HTA dei dispositivi medici da parte del National Institute for Health and Care Excellence (NICE) non è obbligatoria, ma può accelerarne l’adozione all’interno del Servizio Sanitario Nazionale (NHS).
Una valutazione NICE positiva non comporta direttamente il finanziamento da parte della NHS poiché le organizzazioni subnazionali o locali decidono in merito ad approvvigionamento prezzi e rimborsi. Tuttavia, esistono diversi percorsi di valutazione applicabili anche ai dispositivi medici digitali.
Le tecnologie con già solide evidenze cliniche possono essere sottoposte a una valutazione HTA completa da parte del NICE attraverso diversi percorsi, in termini di linea guida e comitati, a seconda della tecnologia e del percorso clinico e del suo impatto previsto sulla spesa sanitaria e socioassistenziale.
EVA
Di recente, il percorso di valutazione precoce del valore (EVA) del NICE è stato istituito come procedura accelerata per tecnologie promettenti, tra cui il digitale, che soddisfano specifici bisogni insoddisfatti in aree cliniche ad alta priorità, ma richiedono ulteriori evidenze. Le raccomandazioni sulle aree tematiche prioritarie provengono dal coinvolgimento dell’NHS e di altri stakeholder, con particolare attenzione a quelle che possono avere il maggiore impatto.
L’ EVA consente la revisione di più tecnologie che perseguono lo stesso scopo. Ciò per identificare le soluzioni più promettenti e sviluppare un piano di generazione di evidenze in modo da valutarne l’efficacia nel mondo reale.
Le tecnologie vengono esaminate da un comitato e la valutazione dà origine a tre opzioni di raccomandazione:
- raccomandazioni e condizionata per l’uso nel NHS in attesa di ulteriori evidenze;
- raccomandazione nella ricerca;
- non raccomandazione per l’uso.
Una raccomandazione condizionata non comporta direttamente un finanziamento da parte del NHS, ma le aziende possono richiedere un supporto finanziario per la generazione di evidenze. L’ EVA consente raccomandazioni condizionate fino a un massimo di quattro anni, con una rivalutazione prevista prima di tale periodo, quando saranno disponibili ulteriori evidenze. I dispositivi digitali devono essere sottoposti a una valutazione nazionale da parte del NICE o dell’organizzazione del servizio sanitario nazionale che acquista la tecnologia, oltre all’approvazione normativa e alla registrazione da parte dell’MHRA in modo tale da essere immessi sul mercato.
I Criteri di Valutazione delle Tecnologie Digitali (DTAC) garantiscono che i prodotti soddisfino gli standard nazionali in materia di sicurezza clinica, protezione dei dati, sicurezza tecnica, interoperabilità, usabilità e accessibilità.
Normare l’Health Tecnology Assessment in Italia
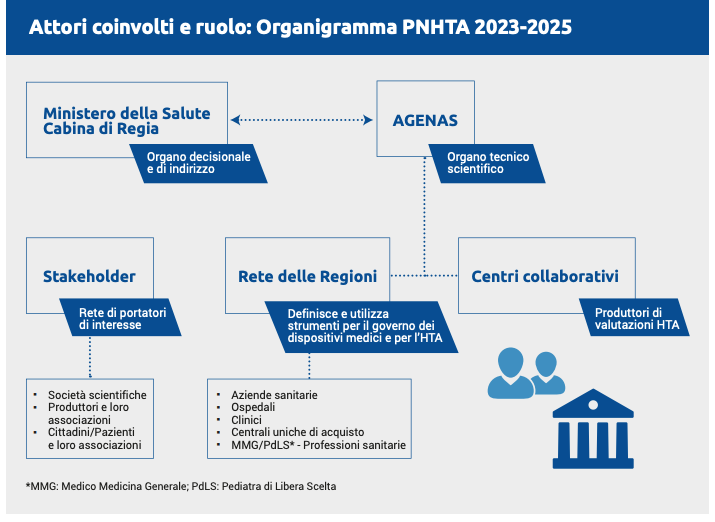
Il Decreto 9 giugno 2023 a cura del Ministero della Salute ha adottato il Programma nazionale HTA per il triennio 2023-2025, sulla scia del Programma Nazionale HTA dispositivi medici (PNHTA), previsto dalla Legge 23 dicembre 2014, n. 190.
Tale disposto normativo è ora in grado di normare l’Health Tecnology Assessment nel modo che segue.
La segnalazione di una tecnologia sanitaria può avvenire tramite proposta di valutazione avanzata da:
- Ministero della Salute;
- Regioni;
- Aziende sanitarie, per il tramite delle Regioni;
- Professionisti del Servizio Sanitario Nazionale, per il tramite delle Regioni;
- Società Scientifiche;
- Produttori e loro associazioni;
- Cittadini/Pazienti e loro associazioni.
La valutazione di AGENAS
La successiva valutazione viene realizzata da AGENAS, attraverso la sua Cabina di Regia (CdR), che potrà esprimere le seguenti raccomandazioni:
- la tecnologia non presenta (al momento) elementi che ne suggeriscano l’introduzione nella pratica diffusa del SSN (per efficacia non dimostrata, o elementi di sicurezza non valutati etc.);
- L’introduzione della tecnologia in un percorso assistenziale comporterebbe benefici;
- La tecnologia è raccomandata solo per l’utilizzo in programmi di ricerca, condotti secondo la disciplina attuale, per la produzione di ulteriori prove scientifiche.
- l’introduzione della tecnologia nel SSN può essere ammessa subordinatamente alla raccolta contestuale di prove scientifiche sull’efficacia reale e dati di costo, previa approvazione della Cabina di Regia.
Le sopra citate raccomandazioni vengono poi pubblicate a cura del Ministero della salute e trasmesse per i provvedimenti conseguenti a:
- Commissione nazionale LEA;
- Commissione permanente tariffe;
- Direzioni Regionali;
- Soggetti istituzionalmente coinvolti nei processi di acquisizione dei dispositivi medici (Tavolo dei soggetti aggregatori, centrali di acquisto, stazioni appaltanti, aziende sanitarie);
- Soggetti istituzionalmente coinvolti nella ricerca.
La messa a regime dei dispositivi medici, quindi l’introduzione nella pratica clinica di dispositivi HTA, è un processo molto veloce, tale da richiedere una attività di analisi e valutazione delle richieste di acquisto, sviluppato su due livelli, rivolto alle strutture sanitarie e ai professionisti:
- il livello della formulazione della richiesta di acquisto e delle relative motivazioni;
- il livello della autorizzazione all’acquisto, per approfondire gli elementi valutativi essenziali che devono essere presi in considerazione prima di attivare una procedura di acquisto di nuovi dispositivi.
Riepilogando:
Fonte Agenas
Conclusioni
Sulla scia di quanto abbiamo pubblicato in un recente articolo dove si evidenziavano gli strumenti di valutazione e classificazione delle tecnologie digitali non possiamo non considerare l’incipit che “allora” abbiamo lanciato.
“La comunicazione mediatica, soprattutto nel caso dell’AI, corre più veloce della realtà. L’anello debole è rappresentato dal fatto che tali strumenti si evolvono più rapidamente dei metodi utilizzati per valutarli.”
La stessa introduzione del World Wide Web ad opera di Tim Berners-Lee, nel 1991 fu così rapida da mettere in difficoltà i vari sistemi normativi mondiali, non pronti ad affrontare una rivoluzione informatica così rapida.
Oggi siamo di fronte ad innumerevoli sfide, in particolare nel campo sanitario. Diviene quindi indispensabile stare al loro passo, anche riguardo i sistemi di regolamentazione ed approvazione.
In ballo c’è la Salute dei cittadini, il bene più prezioso da salvaguardare!











