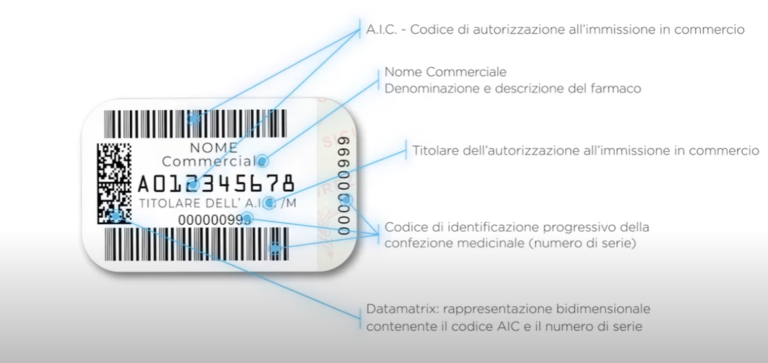
Con la Determina DTS 56/2025, pubblicata il 17 luglio, l’Agenzia Italiana del Farmaco (AIFA) ha adottato le istruzioni applicative per l’attuazione dell’articolo 4 del decreto legislativo 6 febbraio 2025, n. 10. A partire dal 9 febbraio 2025, tutte le confezioni di medicinali soggetti a prescrizione dovranno riportare un Identificativo Univoco (UI) leggibile in Data Matrix e un Dispositivo Anti-Manomissione (ATD). La misura risponde all’obbligo di armonizzazione con il Regolamento delegato (UE) 2016/161, che mira a prevenire l’ingresso di farmaci falsificati nella catena legale di distribuzione.
Periodo transitorio di due anni per l’adeguamento
Le nuove regole sono entrate in vigore il 9 febbraio 2025. Da quella data, tutte le confezioni di medicinali soggetti a prescrizione devono riportare l’Identificativo Univoco (UI) in Data Matrix e il Dispositivo Anti-Manomissione (ATD). Tuttavia, è previsto un periodo transitorio fino all’8 febbraio 2027, durante il quale possono ancora essere commercializzate confezioni prive di UI e ATD, purché prodotte, autorizzate o importate prima dell’entrata in vigore e dotate del bollino farmaceutico tradizionale.
Le istruzioni operative nel dettaglio
Il documento allegato alla Determina (Allegato 1) fornisce indicazioni puntuali sulle modalità con cui i titolari di AIC (Autorizzazione all’Immissione in Commercio), AIP (Autorizzazione all’Importazione Parallela) e le aziende distributrici devono ottemperare agli obblighi normativi.
Per i medicinali autorizzati con procedura nazionale o mutuo riconoscimento, le domande presentate a partire dal 9 febbraio 2025 dovranno includere direttamente nei moduli QRD le sezioni 17 (UI) e 18 (ATD). Le richieste già in valutazione, invece, dovranno essere integrate tramite notifica via CESP accompagnata da mock-up aggiornati.
Nel caso delle importazioni parallele, le domande presentate da tale data dovranno essere corredate di mock-up conformi, trasmessi via PEC secondo l’art. 78 del d.lgs. 219/2006. In assenza di variazioni, è prevista una procedura semplificata per i prodotti il cui corrispettivo italiano sia già stato adeguato.
Nessuna comunicazione per i medicinali centralizzati
Per i prodotti autorizzati tramite procedura centralizzata, non sono richieste notifiche ad AIFA. Il QRD template utilizzato a livello europeo già prevede infatti le sezioni dedicate a UI e ATD. Allo stesso modo, non è necessaria alcuna comunicazione per le variazioni strettamente legate all’introduzione di ATD o per modifiche grafiche all’UI che non incidano sulla leggibilità delle informazioni.
Tuttavia, nei casi in cui l’inserimento dell’ATD comprometta la leggibilità di altre informazioni obbligatorie in etichetta, le aziende sono tenute a sottoporre ad AIFA una proposta di adeguamento grafico per l’approvazione.
Come funziona il nuovo codice UI
L’Identificativo Univoco consiste in un Data Matrix bidimensionale contenente:
- Codice prodotto;
- Numero di serie univoco;
- Numero di lotto;
- Data di scadenza.
Questi elementi dovranno essere riportati sia in formato leggibile a occhio nudo sia scansionabili elettronicamente, e dovranno essere generati e gestiti secondo i requisiti tecnici stabiliti dal Regolamento UE. Il sistema permetterà di verificare l’autenticità di ogni singola confezione durante le fasi di distribuzione, dispensazione e controllo.
Chi è escluso dall’obbligo
Sono esclusi dal nuovo regime:
- I medicinali non soggetti a prescrizione medica (OTC);
- I prodotti indicati nell’Allegato I del Regolamento delegato (UE) 2016/161;
- Le categorie indicate all’art. 5-bis, comma 2, del d.lgs. 540/1992.
Inoltre, è previsto che le confezioni prodotte o importate prima del 9 febbraio 2025 possano continuare a essere distribuite fino alla scadenza naturale, anche se prive di UI e ATD, purché dotate di bollino tradizionale.