Certamente esistono, e sono numerosi, ma come valutare gli effetti e i benefici che le tecnologie sanitarie digitali sono in grado di fornire all’utente e al Sistema Sanitario in generale? La comunicazione mediatica, soprattutto nel caso dell’AI, corre più veloce della realtà. L’anello debole è rappresentato dal fatto che tali strumenti si evolvono più rapidamente dei metodi utilizzati per valutarli. È un bene, pertanto, che l’Organizzazione per la Cooperazione e lo Sviluppo Economico (OCSE) abbia elaborato un documento di lavoro con l’intento di identificare buone pratiche nella valutazione delle tecnologie sanitarie digitali (DHT).
Definizione
L’Organizzazione Internazionale per la Standardizzazione (ISO) definisce una tecnologia sanitaria digitale come un sistema che utilizza piattaforme informatiche, connettività, software e sensori per l’assistenza sanitaria e usi correlati. Può abbracciare un’ampia gamma di utilizzi: dalle applicazioni per il benessere rivolte al paziente, ai sistemi di prescrizione elettronica rivolti ai medici, le piattaforme di telemedicina, fino agli strumenti diagnostici e alle terapie digitali.
L’Organizzazione Mondiale della Sanità nel 2023 ha pubblicato la seconda edizione della classificazione degli interventi, servizi e applicazioni digitali in ambito sanitario. Questa tassonomia caratterizza il modo in cui le tecnologie digitali e mobili si usano per supportare le esigenze individuali e sanitarie in base alle loro finalità. Si basa sulla:
- identificazione dell’utente primario target della tecnologia (ad esempio persone, operatori sanitari, personale di gestione dei sistemi sanitari, servizi dati);
- caratterizzazione della tecnologia in base al tipo di interventi di salute digitale che può erogare;
- connessione di quanto sopra indicato al tipo di software e sistemi di tecnologie dell’informazione e della comunicazione che erogano l’intervento.
Il National Institute for Health and Care Excellence (NICE) nel suo Evidence Standards Framework for Digital Health Technologies (ESF) definisce i DHT come prodotti digitali destinati a beneficio delle persone o del più ampio sistema sanitario e socioassistenziale.
L’International Network of Agencies for Health Technology Assessment (INAHTA) considera l’HTA come un processo multidisciplinare che utilizza metodi espliciti per determinare il valore di una tecnologia sanitaria in diverse fasi del suo ciclo di vita. Lo scopo è quello di informare il processo decisionale al fine di promuovere un sistema sanitario equo, efficiente di alta qualità.
Categorizzazione e classificazione delle tecnologie sanitarie digitali
L’International Medical Device Regolators Forum ha sviluppato alcuni documenti relativi proprio ai dispositivi medici e nel 2013 ha introdotto il concetto di SaMD (Software as a Medical Device). Da tale evoluzione è nata la categorizzazione riportata nella seguente tabella:
| Stato della situazione o condizione sanitaria | Importanza delle informazioni fornite da SaMD per la decisione sanitaria | ||
| Trattare o diagnosticare | Guidare la gestione clinica | Informare la gestione clinica | |
| Critico | IV | III | II |
| Serio | III | II | |
| Non grave | II | ||
Legenda: maggiore è il rischio per il paziente o per la salute pubblica, maggiore è la categoria:
IV = impatto molto elevato; III = impatto elevato; II = impatto medio; I = impatto basso.
Lo stesso NICE ha ideato un sistema di classificazione in grado di supportare lo sviluppo e la successiva valutazione dei DHT che potrebbero essere implementati nel sistema sanitario e assistenziale del Regno Unito:
A: I DHT mirano a risparmiare sui costi e a liberare tempo al personale sanitario;
B: I DHT aiutano i cittadini e i pazienti a gestire la propria salute e il proprio benessere;
C: I DHT utilizzati per il trattamento e la diagnosi di condizioni mediche o per guidare le scelte di cura.
In Europa abbiamo una ulteriore modalità di catalogazione applicata ai software:
| Classe di rischio | Regola | Esempi |
| Classe III (rischio più elevato) | Software destinato a fornire informazioni a supporto delle decisioni diagnostiche o terapeutiche, il cui impatto può causare la morte o un deterioramento irreversibile della salute | Software destinato alla diagnosi e alla presa di decisioni terapeutiche nei pazienti con Ictus |
| Classe IIb (rischio medio-alto) | Software destinato a fornire informazioni per prendere decisioni diagnostiche o terapeutiche, il cui impatto decisionale può causare un grave peggioramento dello stato di salute di una persona o a causa di un intervento chirurgico | Applicazione mobile progettata per analizzare il battito cardiaco di un utente, rilevare anomalie e informare un medico; software per la diagnosi della depressione basato su un punteggio derivato da dati inseriti dal paziente |
| Software destinato al monitoraggio di parametri fisiologici vitali, la cui natura o variazione potrebbe comportare un pericolo immediato per il paziente | Software destinato alla sorveglianza continua dei processi fisiologici in anestesia o terapia intensiva. | |
| Classe IIa (rischio medio) | Altri software destinati a fornire informazioni per prendere decisioni diagnostiche o terapeutiche | Software che classifica le opzioni di chemioterapia; terapia cognitiva in cui uno specialista determina la terapia necessaria in base al risultato fornito dal software |
| Altri software destinati al monitoraggio dei processi fisiologici | Software per il monitoraggio dei processi fisiologici non vitali; dispositivi per ottenere letture dei segni vitali nel controllo di routine | |
| Classe I (rischio più basso) | Tutti gli altri software | Applicazioni software progettate per supportare il concepimento calcolando lo stato di fertilità in base a input e algoritmo convalidato |
Ciclo di valutazione
Esistono diverse fasi:
- ricerca o sviluppo;
- accesso sul mercato;
- regolamentazione;
- decisioni su copertura e finanziamento;
- adozione da parte di operatori sanitari e pazienti;
- utilizzo reale dei dispositivi.
Un’illustrazione OCSE 2017 fornisce una panoramica generale del ciclo di valutazione dei dispositivi medici digitali.
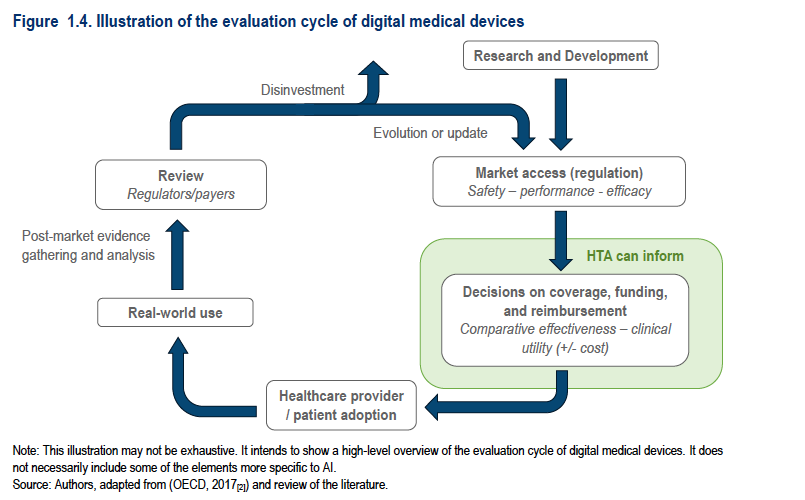
I DHT che rientrano nell’ambito di questo documento sono classificati come dispositivi medici e sono regolamentati come tali. Per accedere al mercato devono essere sottoposti a revisione normativa per garantirne la sicurezza del funzionamento previsto.
Tali normative delineano le leggi e le politiche per la valutazione dei dispositivi medici ai fini dell’approvazione nel mercato (generalmente in termini di sicurezza ed efficacia).
I requisiti normativi variano a seconda della giurisdizione e della categoria di dispositivo. In Israele e Corea, ad esempio, la valutazione e l’approvazione è di competenza di un organo politico. Nei paesi dell’Unione Europea e nel Regno Unito, tale attività è generalmente svolta da enti indipendenti chiamati organismi notificati mentre le agenzie governative competenti sono responsabili della registrazione del dispositivo sul mercato.
Regolamento delle tecnologie sanitarie digitali in Europa
Nell’Unione Europea, i DHT devono essere sottoposti a una valutazione di conformità per dimostrare che soddisfano i requisiti di legge e ne garantiscono la sicurezza e le prestazioni previste. Il Regolamento UE sui Dispositivi Medici (Regolamento 2017/745), (Regolamento EU MDR) è in vigore dal 26 maggio 2021, mentre il Regolamento sui Dispositivi Medico-Diagnostici in Vitro (Regolamento 2017/746), (Regolamento UE IVDR) è in vigore dal 26 maggio 2022.
La valutazione della conformità prevede un audit del sistema di qualità del fabbricante e, a seconda del tipo di dispositivo, una revisione della documentazione tecnica sulla sicurezza e le prestazioni del dispositivo. Per alcuni dispositivi ad alto rischio, gli organismi notificati richiedono anche il parere di gruppi di esperti prima di rilasciare i certificati. In altri, l’organismo notificato può richiedere un parere scientifico all’Agenzia Europea per i Medicinali o all’autorità nazionale competente prima di rilasciare un certificato
Regolamento nel Regno Unito
Dal 1° gennaio 2021, nel Regno Unito sono state apportate modifiche alle modalità di immissione sul mercato dei dispositivi medici. Tra queste, un nuovo percorso di commercializzazione e una nuova marcatura dei prodotti: la marcatura UKCA (UK Conformity Assessed).
La Medicines and Healthcare products Regulatory Agency (MHRA) è responsabile della regolamentazione del mercato dei dispositivi medici nel Regno Unito; tutti i dispositivi devono essere registrati presso la MHRA prima di poter essere immessi sul mercato. La stessa MHRA è responsabile della designazione e del monitoraggio degli organismi di valutazione della conformità al fine di condurre valutazioni di adeguatezza rispetto ai requisiti pertinenti per la marcatura UKCA.
Tutti i dispositivi dovranno essere conformi al Regolamento MDR 2022 con misure transitorie per estendere l’accettazione dei dispositivi precedentemente commercializzati con marchio CE fino al 30 giugno 2030, a seconda del tipo di dispositivo e della classificazione (MHRA, 2024).
Conclusioni
Le sfide che stiamo affrontando in ambito sanitario sono il frutto di un connubio fatto da ricerca e scienza. Da alcuni anni a questa alchimia si è aggiunta la tecnologia (rafforzata e ampliata dalla IA). In particolare, le tecnologie digitali stanno permettendo di velocizzare alcuni progetti di ricerca, sono oggi in grado di integrare ed approfondire il lavoro dei clinici sia in fase preventiva che curativa. Certamente è necessaria una loro regolamentazione e standardizzazione a livello mondiale. L’OCSE ha deciso di intraprendere un percorso di confronti, studi, ricerca, con l’obiettivo finale di identificare buone pratiche nella valutazione dei dispositivi digitali. In tal modo, avendo criteri e standard di riferimento sarà più facile beneficiare della evoluzione tecnologica in ambito sanitario a livello mondiale.











