Il Rapporto sulle Attività dell’AIFA, pubblicato sul portale dell’Agenzia Italiana del Farmaco, presenta i dati e le attività principali del 2024 a confronto con i due anni precedenti. Il 2024 è stato segnato dall’avvio della riforma dell’AIFA, con il nuovo assetto e i primi passi per la riorganizzazione interna. Il documento dà conto di questa fase di cambiamento e al contempo delinea gli aspetti salienti del lavoro svolto dall’Agenzia, soffermandosi sui risultati conseguiti, con uno sguardo alle prospettive e agli scenari futuri. Il Rapporto, che si avvale di tabelle, immagini, link di approfondimento e rappresentazioni grafiche dei dati, ha lo scopo di rendere ancora più chiaro e trasparente l’operato dell’Agenzia e promuovere una maggiore conoscenza dei suoi compiti a tutela della salute pubblica.
La nuova AIFA
L’AIFA ha intrapreso nel 2024 un profondo percorso di rinnovamento per dare attuazione al decreto del Ministero della Salute n. 3 dell’8 gennaio 2024. La prima e immediata conseguenza della riforma ha riguardato la composizione e le funzioni dei vertici istituzionali. Venuta meno la figura del Direttore Generale, cui era attribuita la rappresentanza legale dell’ente, questa è stata trasferita in capo al Presidente. Il presidente è divenuto “organo” insieme al Consiglio di Amministrazione (CdA) e al Collegio dei Revisori dei Conti.
La nuova AIFA si articola complessivamente in due strutture di livello dirigenziale generale (le due Direzioni) che a loro volta si articolano in sei aree e 43 uffici. La Commissione Scientifica ed Economica del farmaco (CSE), di nuova istituzione, ha sostituito la Commissione Tecnico Scientifica (CTS) e il Comitato Prezzi e Rimborso (CPR) accorpandone le funzioni. Il nuovo assetto ha richiesto interventi rapidi ed efficaci per garantire la continuità operativa e l’adeguamento dei processi alla nuova struttura dell’Agenzia. È stato avviato il lavoro per la definizione del nuovo Regolamento di funzionamento e ordinamento del personale e sono state svolte diverse attività a supporto dell’attuazione della riforma.
Queste hanno incluso tra l’altro l’adozione del Regolamento della CSE, la predisposizione del nuovo Regolamento sul conflitto d’interessi, entrato in vigore all’inizio del 2025, e dei necessari regolamenti interni, l’aggiornamento delle procedure operative, l’adozione di un nuovo sistema di classificazione del personale non dirigenziale, l’avvio di tavoli di lavoro e progetti di ascolto e dialogo con le associazioni dei pazienti, i medici, le società scientifiche e le aziende. La proposta di Regolamento, con annessa la rimodulazione della dotazione organica, è stata approvata dal CdA a novembre 2024 e trasmessa ai Ministeri vigilanti.
Il nuovo processo di valutazione dei medicinali
Nel corso del 2024, il sistema di valutazione dei farmaci ha subito una significativa modifica come parte del processo di riforma e riorganizzazione dell’Agenzia. Nel mese di marzo si è insediata la CSE, che ha assorbito le funzioni precedentemente svolte separatamente dalla CTS e dal CPR. Questo significa che il nuovo organismo è responsabile degli aspetti tecnico-scientifici. Ne sono degli esempi la valutazione delle domande di registrazione nazionali e comunitarie e la classificazione dei medicinali ai fini della rimborsabilità. Oltre a ciò, è responsabile anche delle attività economico-negoziali (la negoziazione del prezzo dei farmaci rimborsati dal SSN).
Il ruolo della CSE è rilevante nel riconoscere e premiare i farmaci realmente innovativi e nell’implementazione del nuovo Regolamento europeo sulla valutazione delle tecnologie sanitarie. Questo incide sui processi valutativi nazionali, inclusa la definizione di rimborsabilità e prezzo. La CSE, composta da dieci esperti, ha lavorato con riunioni mensili di cinque giorni più una serie di sedute straordinarie. La conduzione parallela dei due processi di valutazione scientifica ed economica e la riorganizzazione dei flussi interni di lavoro con gli uffici a supporto della Commissione hanno consentito nei primi mesi di attività di smaltire i dossier arretrati e di accelerare i tempi delle procedure.
Accesso ai farmaci e appropriatezza terapeutica
La nuova AIFA ha posto al centro della propria attività temi cruciali come l’accesso ai farmaci, la rimborsabilità, l’appropriatezza prescrittiva e l’aderenza terapeutica, adottando un approccio improntato alla collaborazione con medici, società scientifiche e istituzioni. In questo contesto si inseriscono diverse iniziative avviate nel 2024, con l’obiettivo di modernizzare i processi e migliorare l’efficacia delle cure.

Una delle azioni principali è stata l’istituzione del Tavolo tecnico su medicina di precisione e prescrittomica, creato dopo un avviso pubblico rivolto a società scientifiche e organizzazioni sindacali. Il Tavolo ha il compito di sviluppare linee di indirizzo sull’applicazione della medicina di precisione nella gestione della terapia farmacologica, con particolare attenzione alla politerapia. Mira, inoltre, a definire nuovi approcci per ottimizzare la qualità delle prescrizioni basate su dati genetici e biochimici. A questo organismo partecipano esperti dell’Agenzia, rappresentanti delle professioni sanitarie, società scientifiche e accademici, già riuniti in gruppi di lavoro tematici.
Parallelamente, AIFA ha avviato un secondo Tavolo tecnico dedicato alla revisione delle Note e dei Piani Terapeutici, con la presenza di Ordini professionali, medici di medicina generale e società scientifiche. L’obiettivo è semplificare e razionalizzare le Note AIFA secondo criteri di appropriatezza e solide evidenze scientifiche, valutando al contempo la possibilità di sostituire i Piani Terapeutici con linee guida prescrittive vincolanti. Tale cambiamento permetterebbe di ridurre procedure e tempi di attesa, facilitando l’accesso alle terapie da parte dei pazienti. Il Tavolo dovrà produrre un documento istruttorio a supporto della Commissione Scientifica ed Economica.
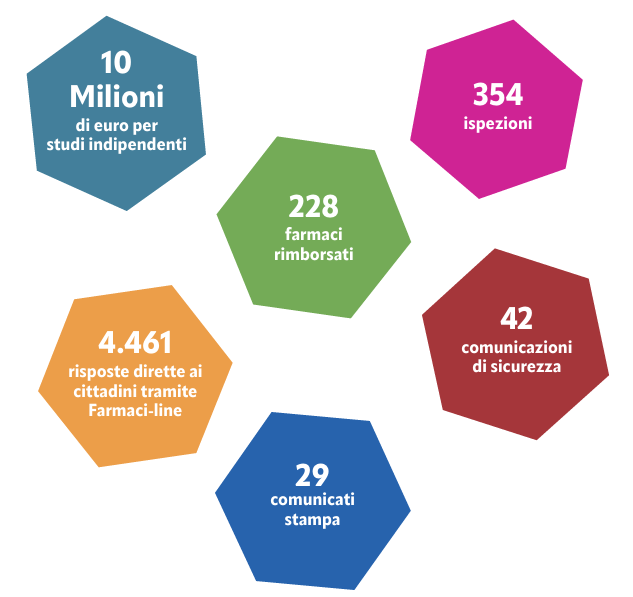
Infine, per garantire un accesso più rapido ai trattamenti cronici, nel 2024 è stata avviata la riclassificazione in fascia A di alcune categorie di farmaci. In tal modo se ne consente l’acquisto diretto in farmacia senza passare dalle strutture ospedaliere. La prima classe coinvolta è quella delle gliptine, farmaci impiegati nel trattamento del diabete.
Digitalizzazione
La digitalizzazione per l’Agenzia non è solo un processo di modernizzazione tecnologica. Si tratta di una strategia chiave per ottimizzare le operazioni interne, migliorare l’accesso e la trasparenza dei servizi per cittadini, operatori sanitari e aziende e rafforzare il ruolo dell’Agenzia nel panorama regolatorio nazionale ed europeo. Tutto questo è possibile farlo integrando anche strumenti innovativi come l’intelligenza artificiale.
Ad aprile 2024 si è conclusa la migrazione del portale istituzionale nel Polo Strategico Nazionale (PSN). Il 2024, come l’anno precedente, è stato caratterizzato da una forte spinta alla digitalizzazione dei processi. Nel concreto questa si è focalizzata sulla migrazione al Cloud, sul rafforzamento della cybersicurezza e sul rilascio di numerosi nuovi servizi digitali per le aree operative. L’obiettivo è di migliorare l’efficienza interna e la trasparenza verso i cittadini e le imprese e di facilitarne l’accesso. Una crescente interoperabilità con i sistemi informativi delle istituzioni nazionali (tra cui il Ministero dell’Economia e delle Finanze e il Ministero della Salute) e dell’EMA.
Nel 2024 è stato rilasciato il portale di e-submission per l’acquisizione dei dossier farmaceutici relativi alle domande di autorizzazione/variazione all’immissione in commercio di medicinali sottomessi tramite il portale europeo CESP. Inoltre, è in corso di implementazione l’interoperabilità con la Piattaforma Europea di Monitoraggio delle Carenze (ESMP) in linea con la roadmap dell’EMA.
L’Agenzia ha condotto uno studio esplorativo sull’AI, inclusa una POC (Proof of Concept) per valutarne gli ambiti di potenziale applicazione e le criticità associate. I sistemi di AI dell’AIFA, come quelli testati nella POC, sono progettati per analizzare documenti dell’EMA e altri portali scientifici online. In questo modo si supporta gli esperti dell’Agenzia nei processi di horizon scanning e knowledge discovery.
Informazione, comunicazione e trasparenza
Con la riforma avviata nel 2024, l’AIFA ha dato un nuovo impulso ai rapporti con i media e all’uso dei canali social. Si intende fornire in modo proattivo informazioni qualificate su temi quali l’uso consapevole dei medicinali, la farmacovigilanza, l’antibiotico-resistenza, i nuovi farmaci in arrivo, i medicinali rimborsati, le carenze, l’andamento della spesa. Questo approccio ha consentito di prevenire interpretazioni fuorvianti e limitare la circolazione di informazioni scorrette e fake news. Particolare attenzione è stata dedicata alla sensibilizzazione dei cittadini e degli operatori sanitari sul corretto uso degli antibiotici, con una campagna nazionale e diversi approfondimenti.
L’Agenzia ha inoltre promosso, in collaborazione con le Regioni e altre istituzioni sanitarie e stakeholder, il progetto “COSIsiFA”. L’iniziativa ha l’obiettivo di fornire informazioni scientifiche indipendenti sui farmaci a operatori sanitari, pazienti, associazioni di pazienti e cittadini. Il nuovo corso dell’Agenzia è stato improntato a un’attenzione rafforzata al dialogo con i propri stakeholder, in primis i cittadini. Il rapporto è improntato alla trasparenza e alla semplificazione dei processi e dei servizi.
In quest’ottica è stato predisposto il nuovo Regolamento sui conflitti d’interesse, è stato adottato quello in materia di accesso documentale, civico e generalizzato. In aggiunta, sono stati aggiornati il Codice di comportamento. Il fine è di includere l’uso delle tecnologie informatiche, l’etica pubblica e i social media, e le misure di prevenzione della corruzione. La trasformazione digitale in corso mira, inoltre, a promuovere la partecipazione degli interessati all’attività amministrativa e favorire forme diffuse di controllo su obiettivi, azioni e utilizzo delle risorse pubbliche.